表面张力,我们简单形象地理解,可以认为流体的两相(如气液)界面就像是一张紧绷的皮膜,这张膜在外力的约束下,总是希望尽可能地收缩。沿着它的表面就有一种张力,就是表面张力。
今天来说一个和表面张力息息相关的现象。
「沾水之后的两片玻璃为何很难分开?」
这是一个非常典型的「看似很简单,其实很复杂」的问题。流行的科普(甚至中学物理课上)上似乎讲的很清楚,但是其实真正的原因并没有讲明白。
流行科普上讲,由于玻璃之间充满了水,它们之间没有空气,因而靠大气压就可以把它们紧密地挤压在一起。如下图所示:
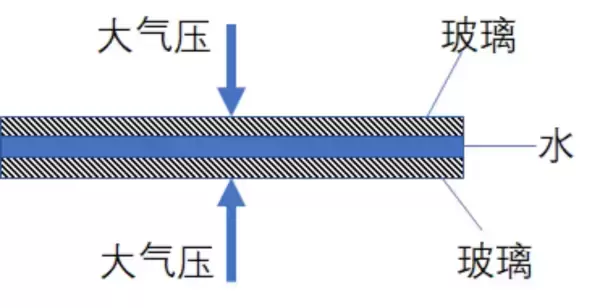
但是这个答案其实并不正确,或者说并不准确。
因为我们知道,水也是满足帕斯卡原理的。大气压并不仅仅是作用在玻璃表面的,玻璃中间的水也与大气有接触,因而大气压也会作用在缝隙中的水上的。由帕斯卡原理,外界的大气压力是可以经由水传递到玻璃间隙之中的。
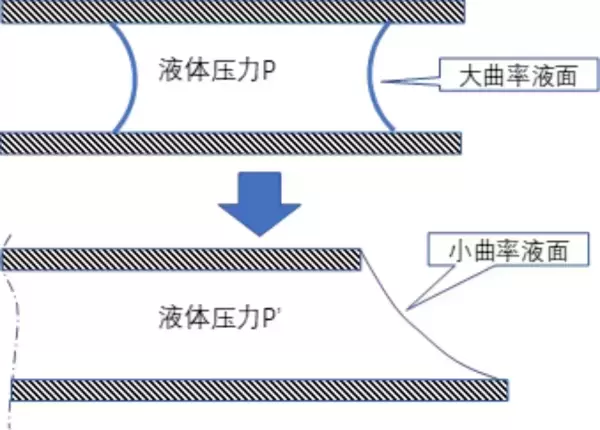
所以仅仅是有水的填充,玻璃不会「被大气压挤压在一起」。我们可以用下面的局部放大图来说明这种情况:
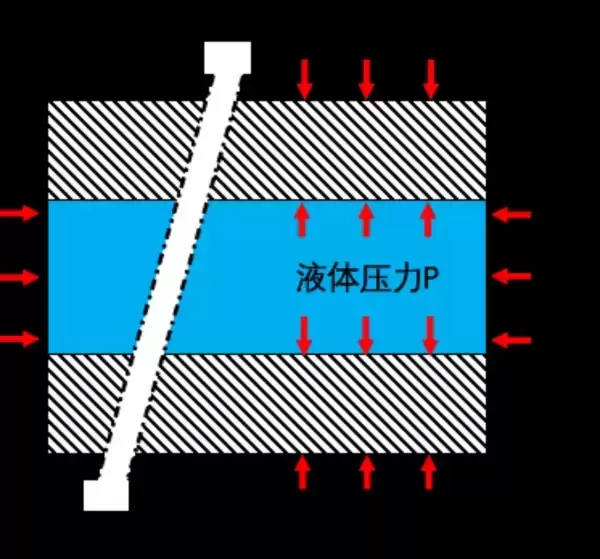
也就是说,由于帕斯卡原理,缝隙中的水也会将大气压传递到两片玻璃的缝隙内部。大气压的作用效果并非是「向内」挤压两片玻璃,因为在缝隙内部同样存在着压力。
说到底,液体和气体对大气压的传递是相同的,因此单纯从压力的传递来讲,玻璃片中间有水还是没有水并不会产生不同的效果。
这里的真实原因,其实是表面张力与大气压的共同作用。
简言之,上面的图稍微有点错误:水和大气的界面不是平的,而应该是一个凹液面。而恰恰是这个凹液面,导致了完全不同的结果。具体讲,就是使得液体内部的压力低于外部的大气压力。
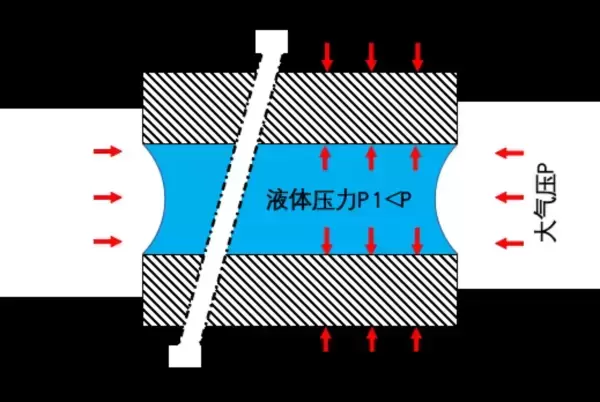
而这里的罪魁祸首,就是表面张力。
表面张力,我们简单形象地理解,可以认为流体的两相(如气液)界面就像是一张紧绷的皮膜,这张膜在外力的约束下,总是希望尽可能地收缩。沿着它的表面就有一种张力,就是表面张力。
如果你想用最形象的方式理解表面张力,你可以想象一个吹起来的气球的表面:气球的弹力使它尽量收缩从而整体形成球形。相对应地,水滴的表面张力使它尽量收缩从而形成球形。

而这里有一件非常关键的事请,就是由于表面张力的存在,弯曲的表面就会在两侧形成压力差。
比如说,无重力液滴是一个球形。我们对一个这样的液滴的上半球做一个受力分析,它受到三个力的作用:
1. 下半球在截面上对它的净压力;
2. 外部在上半球面上对它的净压力
3. 液滴表面受到的沿表面垂直于「断面」的表面张力。
我们很容易就会看到,由于表面张力的存在,此时内部的压力肯定要大于外部压力。其实这个很容易理解:一个气球就是典型内部压力大于外部压力的例子,这种压力差,就是有张力的皮膜形成的。那么,这种压力差的大小是由什么决定的呢?
很显然,一个决定因素就是张力的大小:皮膜绷的越紧,所能产生的压力差就越大。但是还有另一个很重要的因素,就是表面弯曲的程度,也就是它的曲率。我们还是用气球做一个说明,例如下面这个气球:
气球内部的气体压力处处相等,因此,气球内外的压差是一个常数。但是,接触过这种气球的人都有一个经验,就是粗的地方绷得紧,而细的地方绷得就不那么紧。也就是说,在起球不同的地方,皮膜的张力是不同的,如上图所示。那么问题就来了,绷得紧的地方和绷得松的地方,产生的压力差却是相等的,这是为何?
原因是,在绷得紧和绷得松的地方,皮膜的曲率是不相等的:曲率越大,同样的张力所能产生的压力差就更大;曲率越小,同样的张力产生的压力差就越小。反过来说,如果产生同样的压力差,曲率大的地方,所需要的张力就越小(在气球细的地方,皮膜就松)。反之亦然(在气球粗的地方皮膜就紧)。
我们有一个公式可以表示这个关系,叫做杨-拉普拉斯方程(Young-Laplace equation):
\Delta p=\gamma\left( \frac{1}{R_1}+\frac{1}{R_2} \right)\Delta p=\gamma\left( \frac{1}{R_1}+\frac{1}{R_2} \right)
其中,γ是表面张力,R1 和 R2 分别是两个方向上的曲率半径。
现在,我们可以来分析一下沾水的玻璃为何很难分开了。
首先,我们知道,液体与固体界面相接触,都会形成一个接触角。接触角也是表面张力的性质之一,这里我就不展开说了。接触角小于 90°的,被称作浸润(如水对玻璃就是浸润的),大于 90°的,叫做不浸润(如水银对玻璃就是不浸润的)。
在两片玻璃之间,形成的凹液面就是因为这个接触角的原因:
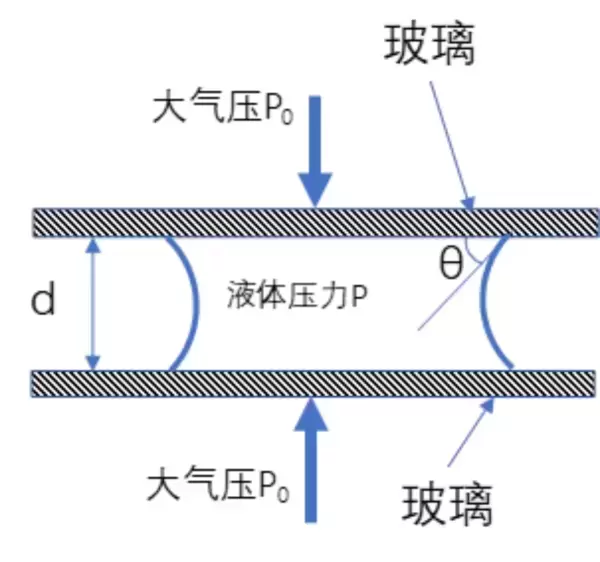
我们看到,这个凹液面就形成了一个「反向」的紧绷的膜。就像是气球一个道理,这种曲面的膜,由于表面张力的原因,就会使得液体的压力 P 小于外部大气压 P0。因而把玻璃挤压在一起的力,就不是 P0 而是 P0-P。
我们可以想象,当两片玻璃间隙非常小的时候,这个凹液面的曲率就会非常大,在这个时候,液体压力与大气压的差就会很大,因此把玻璃挤压在一起的力也就很大。我们可以用杨-拉普拉斯公式来估算一下。
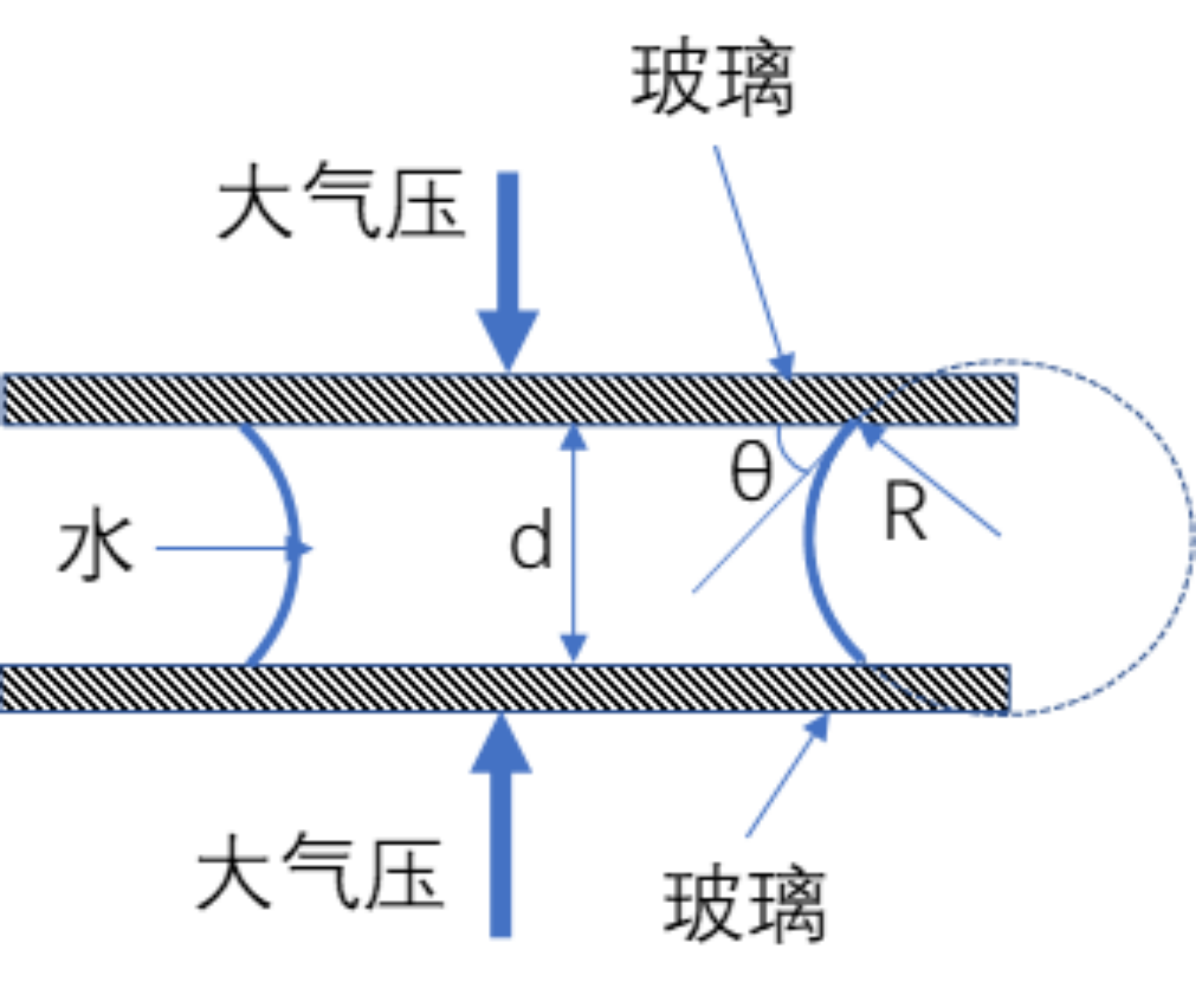
这个凹液面沿着我们切面的视角上的曲率半径是(假设玻璃的间隙为 d):
R=\frac{d}{2cos\theta}R=\frac{d}{2cos\theta}
因此,根据杨-拉普拉斯方程(我们假设液膜面积尺度远大于间隙尺度),这个凹液面所产生的液体内部与大气之间的压力差为:
\Delta p=\frac{\gamma}{R}=\gamma\frac{2cos\theta}{d}\Delta p=\frac{\gamma}{R}=\gamma\frac{2cos\theta}{d}
请注意,这里形成的压力差是负值。
已知我们做能做的最好的玻璃面,其表面粗糙度仅有纳米级。而普通玻璃,也只有零点几到零点零几微米的尺度。因此两片玻璃之间的缝隙,显然不是由粗糙度决定的。
对于面积比较小的玻璃(翘曲忽略不计),这里考虑的是表面清洁度:也就是说,由于玻璃表面的污渍存在,会使得两片玻璃表面不能严密贴合。一般 10 微米以上的灰尘我们肉眼都是能看见的,而在这之下就很难看到,2 微米之下就无法看到了。所以我这里假设我们一般对玻璃表面清洁会留有 10 微米基本的污渍,也就是说,两片(面积不大的)玻璃的缝隙数量级在 5 微米左右。
常温下水的表面张力大约为 0.073N/m。水在普通玻璃上的接触角大约为 30°左右。因此,对于贴合较好的两片玻璃片,很容易计算出这个液膜内部的压力与大气压的压力差为 25Kpa – 大约为大气压的 1/4 左右。
也就是说,液膜内部压力比大气压小 25Kpa。对于这样 10cm2 的两片玻璃,如果我们用一点水把它「沾」在一起,我们需要大约 250N 的力才能掰开 – 虽然很难,但是如果有抓手的话还是有可能的。
但是如果是按照流行科普的说法(液膜排出空气导致玻璃间隙压力为零),我们所需要 1000N 的力才能掰开,这个就不太可能了。
我们可以做一个实验,来验证这个解释。我做了这样一个动图:

我们可以看到,两片玻璃被水沾在一起后,还是相当牢固的。

但是当我们向着玻璃缝隙滴几滴水,哪怕只是很少的几滴,它们之间就不再牢固了,随着水的不断滴入,最后就不可避免地分开了。这是因为滴入水不断进入缝隙,最后就会破坏掉前面所述的曲率很大的液面,导致液体压力与外界气压的差迅速降低,于是它们就无法继续沾在一起了。这个过程可以图示如下:
所以说,单纯从「液体占据了缝隙因此内部没有气体」并不能解释玻璃为何能沾在一起。这里面表面张力以及其引发的压力差(杨-拉普拉斯方程)才是关键因素。
这个估算做了很多简化。事实上这里水的凹液面并非是一个严格的弧面,而是随着玻片受力的不同而变化的复杂曲面,需要用流体力学原理和杨-拉普拉斯方程求解,这是高度非线性的复杂偏微分方程。
所以说,这是一个看似简单,但是计算起来极其复杂的现象,并且可以引出更加复杂的理论探讨。
我前面视频中的实验所表明,破坏掉液面的曲率,肯定是会消解掉大部分的粘合力。但是,这里所不能证明的,是这样一个问题:是不是所有的粘合力全部来自表面张力引发的压力差?有没有其它因素?
这个答案就复杂了。我暂时不能明确回答。正如一个知友看了之后说自己试过,浸泡在水中的玻璃片之间,仍然感到有部分的粘合力。但是,这也有可能是因为内部毛细现象的宏观统计体现(就像是工程中的 porous media 中液体的毛细扩散现象一样)。
更可能的是,在水中分开玻璃片感到的粘合力,是一种流体力学效应,而不是静流体效应。也就是说流体内部 relax 需要时间。具体讲,当我们分开玻片的时候,由于玻片之间的缝隙扩大,周围的水必须要填充进去。由于水是一种不可压缩流体,当水没有填充进去的时候,我们是不可能把玻片分开的。
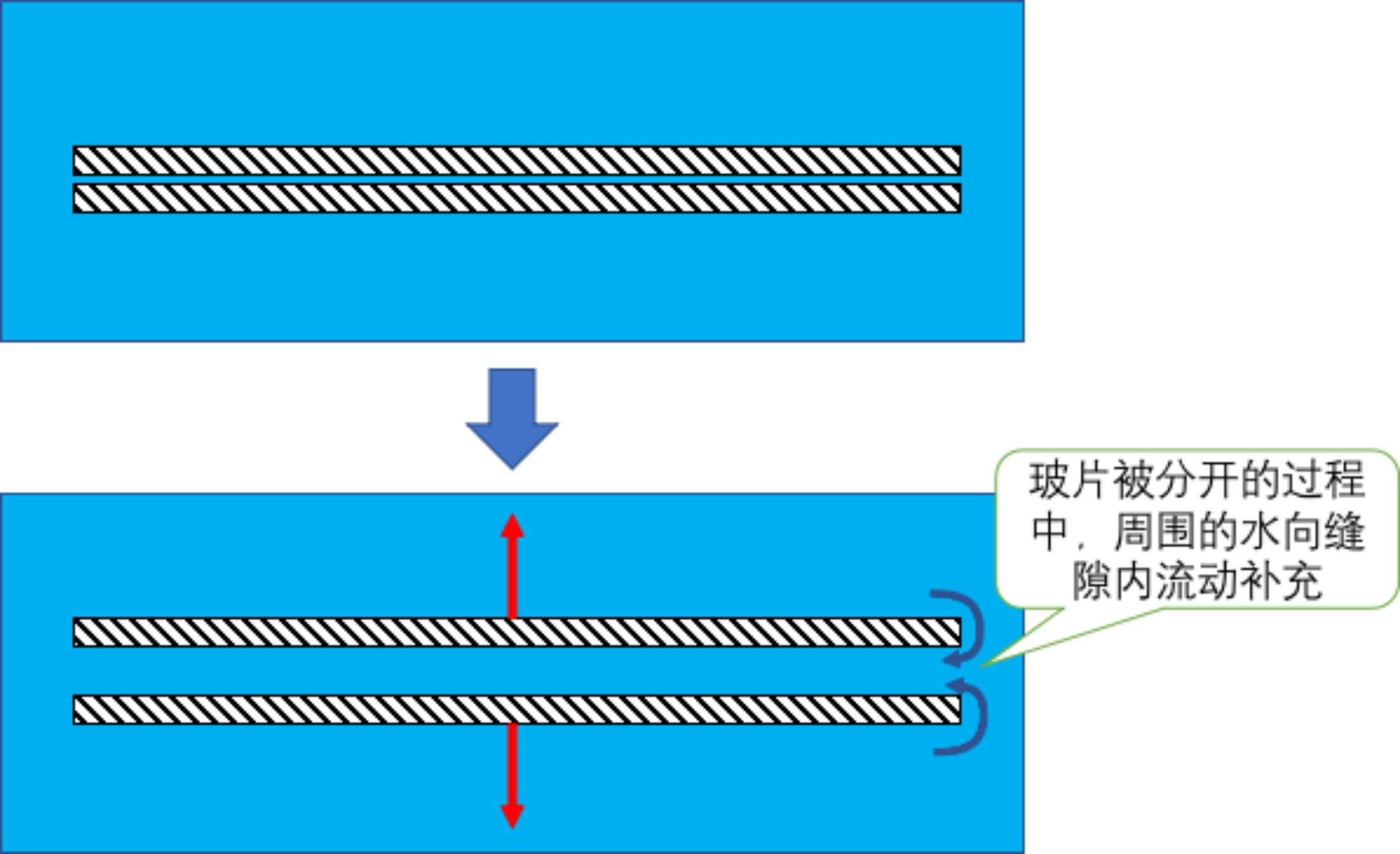
但是,由于玻片间的缝隙非常小,水在向其中流动的过程中,就受到很大的阻力,导致补充缓慢。这就表现为我们无法一下子将玻片分开 – 它似乎存在着粘合力。
我会后续继续设计一个实验来验证它。
但是这里我会先说一下玻璃的表面化学,以及玻璃表面的化学性质可能对这个现象的贡献。
我们都知道,一般而言玻璃是硅酸盐的一种形态(当然会有各种不同的玻璃,这里说的是大多数情况)。在硅酸盐玻璃(甚至是石英玻璃)中,都会有一种所谓的硅醇结构存在。这种结构类似于:
\equiv Si – OH\equiv Si – OH
它有着比较特定的红外吸收特性,因而在光学仪器中,它的存在会使得其应用受到限制。在高纯石英玻璃中,这种结构存在的大约密度为零点几到上千 PPM。我们这里不说它的光学特性,而只是讨论它对表面特性的影响。
当玻璃浸泡在水中的时候,这种硅醇结构就会更加密集地聚集在表面,因为玻璃中的硅氧键在缺陷的部分会与水发生反应,生成这种硅醇结构:
\left( \equiv Si-O-Si\equiv \right) + H_2O\rightarrow \left( \equiv Si-OH \right)……\left( HO-Si\equiv \right)\left( \equiv Si-O-Si\equiv \right) + H_2O\rightarrow \left( \equiv Si-OH \right)……\left( HO-Si\equiv \right)
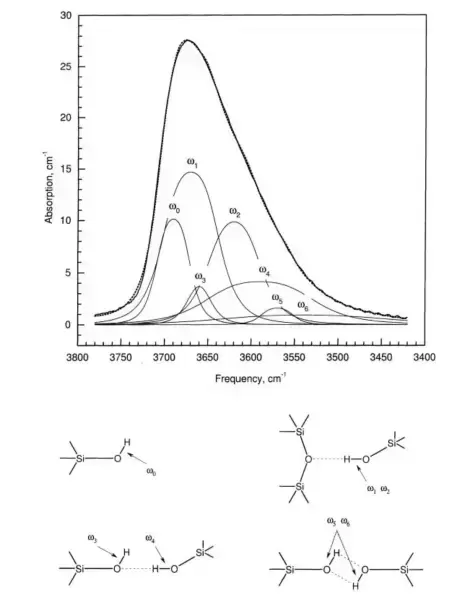
这种羟基结构,学过有机化学的都清楚,非常容易在它们之间形成各种复杂的氢键。这些氢键的结构可以通过红外吸收光谱看到【1】:
并且它们也容易与水形成氢键【2】:
更进一步地,在水中会发生电离反应:
SiOH\Leftrightarrow SiO^-+H^+SiOH\Leftrightarrow SiO^-+H^+
因而就会在玻璃表面带上负电。
玻璃表面负电的特性,与水中的离子就会形成复杂的相互作用。有人用实验测试了水中某种玻璃的带电特性【3】:
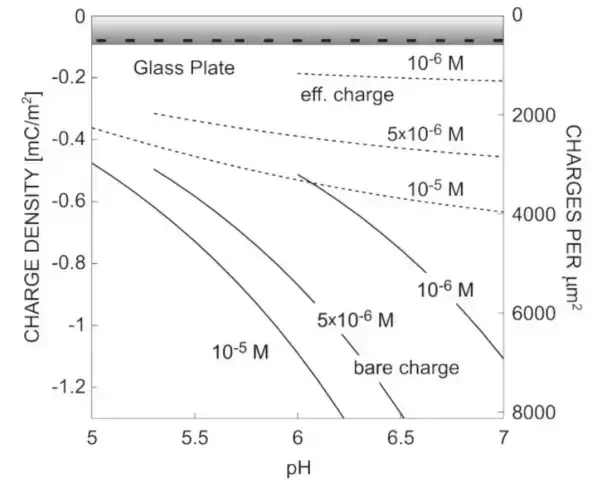
因而,玻璃表面与水之间,就会形成包括了电离、氢键、静电等多种复杂的物理化学相互作用。
当然,这种相互作用涉及到了化学变化,因而只有在玻璃表面互相之间非常非常靠近(诸如纳米级,或者至少是微米以下级别)的时候才会表现出宏观的粘合效应。这就是我一开始并没有把它考虑在内的原因。
如果一对贴合的玻璃片浸泡在水中经过足够长的时间能够自然分开,我们就会下结论,说这种化学作用在这个现象中起到的作用非常有限,可以忽略。否则的话,我们应该下结论,它的宏观效应不能被排除。
我们来做一下实验,这一次是为了验证「对一般的玻璃表面,玻璃的表面化学过程是否直接参与相互吸引(如氢键、静电等行为)」。
有知友指出,即使是完全浸泡在水中,两片紧贴的玻片分开一样很困难。既然是水下,就不会有液体界面,因而就不会有表面张力了。初步试了一下,水下的玻片确实需要一点力气才能分开,但是这并不排除如下几个可能性:
1. 玻璃浸泡时间短,因此水并没有充分进入缝隙,所以缝隙内仍有大量的气液界面存在;
2. 水下分开玻片,需要水填充进玻片的缝隙中,而在分开的刹那,缝隙非常小,因而水填充进去的过程有较大阻力,所以这是个动力学问题,而不是静力学问题(也就是说,不是玻片相互吸引,而是分离速度较慢)。
因此我设计如下实验:
首先,用夹子夹住一片玻片的边缘,使黏在一起的两片玻片能够竖直站立在平面上:

其次,取一盆水,盆底稍作倾斜:

第三,将用水沾在一起的一对玻片完全置于水中,使其竖直。
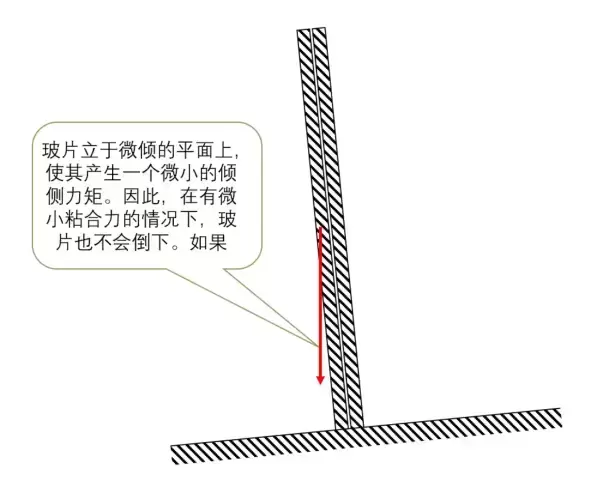
因为盆底稍有倾侧,因而这对玻片也就会稍有倾侧,因此被黏住的玻片受到极小的力矩作用。只要是玻片间能够一直保持吸引,被黏住的玻片就不会倒下,否则,如果没有吸引,或者吸引力非常小,在这个微小力矩作用下,它最终一定会倒下。

这个实验的原理可以大致用下图表示:
实验结果来了:两片玻片大约在两分钟半之后,黏着的那片玻片倒下了。

我们可以看到,玻片的分开过程,从一开始到张开一点点缝隙花了很长时间,但是缝隙一旦张开,它就轰然倒塌了。整个过程近似静态,并且玻片受到的力矩极其微小。因而我们可以认定,在破坏了表面张力以后,最终两个玻片之间不再有显著的吸引力。
所以,结论就是——
至少在本实验所用的玻璃材料(显微镜的载玻片)中,吸引力并不来自玻片的表面化学过程。
通俗点讲,玻片的吸引力来自表面张力引发的大气压的压力差,而不来自玻片之间、或玻片与水之间的直接分子相互作用。
以上。
参考资料:
【1】V.G. Plotnichenko *, V.O. Sokolov, E.M. Dianov,”Hydroxyl groups in high-purity silica glass”
【2】 Jelizaveta Tsedenova,Patrick Storme,Joost Caen,「INFLUENCES OF THE RELATIVE HUMIDITY ON THE STRENGTH OF GLASS BONDS EXECUTED WITH ARALDITE®2020 AND HXTAL™NYL-1」
【3】Sven H. Behrens and David G. Grier,「The Charge of Glass and Silica Surfaces」备案号:YXA1d14KkQDC5QxBRr2tdlxK
评论前必须登录!
注册